Y kromozomu mikrodelesyonları ve erkek infertilitesi
ERKEK ÜREME SAĞLIĞI
Y kromozomu mikrodelesyonları ve erkek infertilitesi, İnfertilite, korunma yöntemi kullanmadan düzenli cinsel ilişkiye rağmen bir yıl içerisinde gebelik sağlanamaması olarak tanımlanmaktadır. Çiftlerin yaklaşık %15’ini etkileyen bu durumun %40–50’sini erkeğe ait nedenler oluşturmaktadır (1,2). Erkek infertilitesinin etiyolojisinde hormonal bozukluklar, ürogenital enfeksiyonlar, cinsel problemler, spermatogenez sürecindeki bozukluklar ve genetik nedenler temel rol oynarlar (3–5). Genetik faktörler dört ana başlık altında toplanabilir;
- 1- Sperm fonksiyonlarını bozan genetik hastalıklar (Primersilier diskinezi, myotonik distrofi, Noonan sendromu,orak hücreli anemi, genetik endokrinopatiler vb).
- 2- Doğumsal duktus agenezisi yapan kistik fibroz (CFTR)gen mutasyonları.
- 3- Kromozom anomalileri
- 4- İzole spermatogenez defekti yapabilen Y kromozom
mikrodelesyonları (6,7).
Spermatogenez primordial germ hücrelerinden sperm üretimiyle sonuçlanan kompleks bir süreçtir. Bu süreçte hem kromozomal seviyede meydana gelen sayısal ve yapısal bozukluklar hem de gen düzeyinde oluşan mutasyonlar infertiliteye neden olabilir. Bunların arasında Y kromozomu erkek germ hücrelerinin gelişimi ve devamlılığının düzenlenmesinden sorumlu olduğundan temel rol oynar (8).
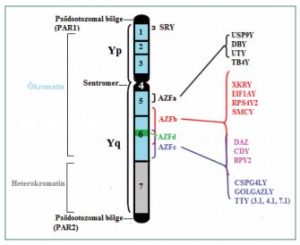
İnsanda Y kromozomu tüm genomun yaklaşık %2–
3’ünü oluşturur. Kısa kolu Yp ve uzun kolu Yq olarak adlandırılır. Y kromozomu psödootozomal, heterokromatin
ve ökromatin bölgelerden oluşur. Psödootozomal bölgeler (PARs) Yp’nin (PAR1) ve Yq’nun (PAR2) uç kısımlarında
bulunur. Bu bölgeler, mayoz esnasında X kromozomunun
psödootozomal bölgeleriyle rekombinasyona girerler.
Psödootozomal bölgede bulunan genler aynı otozomal
genler gibi kalıtılır (9). Y kromozomunun çoğunu (%95)
rekombinasyona girmeyen bölge (NRY) olarak adlandırılan kromozomun heterokromatin ve ökromatin bölgeleri oluşturur.
Heterokromatin bölge Yq’nun distalinde bulunur ve genetik olarak etkisiz kabul edilen bu bölgenin çoğunluğunu tekrar dizileri (DYZ1 ve DYZ2) oluşturur. Ökromatin bölge ise PAR1’in distalinde yer alır ve Yp ve Yq’nun
parasentromerik bölgeleri ile sentromer bölgesini oluşturur (Şekil 1). Cinsiyetin belirlenmesi, gonadoblastom,
boy kontrolü ve Turner stigmata ve spermatogenezden
sorumlu tüm aktif genler bu bölgede lokalize olmuştur (8).
Y kromozomu Mikrodelesyonları ve Oligo/Azospermi
Y kromozomu mikrodelesyonları ve erkek infertilitesi kısa kolundaki (Yp) genler (SRY) testis gelişiminde, uzun kolundaki (Yq) genler ise spermatogenezde rol alırlar. Y kromozomunda bulunan bu genlerin
mikrodelesyonlarıyla infertilite arasında bağlantılar bulunmaktadır. Y kromozomu
mikrodelesyonları ve spermatogenez arasındaki ilişkiyi ilk defa 1976 yılında Tiepolo ve
Zuffardi göstermiştir (10). Tiepolo ve Zuffardi 1170 erkekte yaptıkları karyotip analizi sonucunda 6 azospermik erkekte Yq’nun distalindeki mikrodelesyonları mikroskobik
olarak gözlemlemişlerdir. Altı vakanın ikisinde infertil erkeklerin babalarının normal Y kromozomuna sahip olduğunu ve bu vakalarda delesyonların de novo olduğunu bildirmişlerdir. Bu çalışmalarının sonucunda fertilite geni ya
da gen bölgelerini Y kromozomu üzerinde bulunan azospermia factor (AZF) olarak adlandırmışlardır.
Y kromozomu mikrodelesyonları ve erkek infertilitesi
AZF mikrodelesyonları non-obstrüktif azospermide
%15, şiddetli oligospermide %5–10 görülür. AZF genleri Y kromozomunun uzun kolunda AZFa, AZFb, AZFc ve
AZFd bölgelerinde yer almaktadır (11). AZFa bölgesi diğer
bölgelerden ayrı bulunmaktadır. AZFb ve AZFc bölgeleri
ise, delesyonlarının sonucu fenotipik olarak farklı olmasına
rağmen, dizileri Yq bölgesinde çakışır. Bu bölge AZF b/c
olarak adlandırılır.
AZFa bölgesi Yq’nun 11.21 bölgesinde, interval 5 ‘te
lokalizedir. Bölgenin uzunluğu 1–3 Mb arasındadır. Y kromozomunun AZFa bölgesinde yer alan genler spermatogenezde rol oynarlar. AZFa bölgesinin parsiyel delesyonları hipospermatogenez ile sonuçlanmaktadır. Komplet
delesyonları ise seminifer tubüllerde germ hücre üretimi
ve olgunlaşmasını inhibe eder. Bu durumda TESE (Testicular Sperm Extraction) ile olgun sperm elde edilebildiğini
bildiren bir çalışma henüz literatürde yoktur. AZFa delesyonlu hastalardan alınan testis biyopsilerinde Sertoli Cell
Only (SCO) sendromu görülür. Ayrıca USP9Y ve DBY genlerinin delesyonlarının ise değişken testiküler fenotiple
bağlantılı olduğu bildirilmiştir (11–14).
AZFb bölgesi Yq’da interval 5 ve interval 6 arasında yer
alır. Bu bölge birkaç sıralı gen kopyasının yanısıra çok kopyalı gen aileleri de içerir. AZFb bölgesinde yer alan önemli
genler arasında RBM (RNA binding motif), CDY (Chromodomain Y), XKRY (XK Related Y), EIF1AY (eukaryotic translation initiation factor 1A, Y-linked), RPS4Y2 (Ribosomal
protein S4 Y isoform 2) ve SMCY (Selected Mouse cDNA
on the Y) sayılabilir. RBM, SMCY ve XKRY genleri Y kromozomunun uzun kolunda pek çok kopyaya sahiptir (15,16).
Otuzdan fazla RBM ve pseudogenleri Y kromozomunun
her iki kolunda da bulunmaktadır. Bu genler RBM ve SRGY
tekrarının 4 kopyasını içeren germ hücre spesifik nüklear
proteinler içerirler. RBMY1A1 (RNA binding motif protein,
Y-linked, family 1, member A1) geni RBM gen ailesinin bir
üyesidir ve erkek germ hücrelerinden eksprese olur (17).
Bu gen mRNA saklanmasında ve spermatogenez sırasında
nükleustan taşınmasıyla ilişkilidir. Ayrıca, RBMY1A1 geninin değişiklikleri AZFb mikrodelesyonu fenotipte önemli
rol oynar (18). AZFb bölgesi delesyonlarına sahip hastalarda AZFa delesyonlarının aksine normal spermatogonyum
ve primer spermatosit oluşumu vardır. Ancak pre-mayotik
spermatojenik duraklama ya da SCO sonucunda azospermi görülür. Bu nedenle AZFb delesyonlu hastalarda da
TESE önerilmemektedir (19).
AZF bölgeleri arasında delesyonlar en sık AZFc bölgesinde görülmekte ve bunun sonucu olarak hipospermatogenez meydana gelmektedir. AZFc bölgesi delesyonları
nonobstruktif azospermili erkeklerde yaklaşık %12 iken,
ciddi oligospermisi (sperm sayısı 5 milyondan az) olan
erkeklerde ise yaklaşık %6 oranında görülmektedir (20).
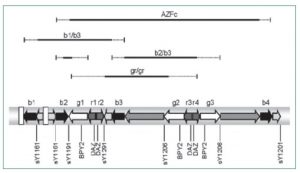
AZFc Yq’nun distalinde lokalize olmuştur ve delesyonları 6C ile 6E subintervalinde meydana gelir. Bu bölgede
lokalize olan 8 ayrı gen ailesi bulunmaktadır. Bunlar; DAZ (Deleted in azoospermia), BPY2 (Testis-specific basic protein Y 2), CDY (Testis-specific chromodomain protein Y),
CSPG4LY(chondroitin sulfate proteoglycan 4-like, Y-linked
pseudogene 1), GOLGAZLY (Golgi autoantigen, golgi subfamily a2-like,Y-linked 1),TTY3.1 (Testis-Specific Transcript,
Y-Linked 3), TTY4.1 ve TTY7.1’dir. Bu genlerden ilk beş
tanesi spermatogenezde temel olan proteinleri kodlarlar.
DAZ gen ailesi 4, BPY2 gen ailesi 3 ve CDY gen ailesi ise 2
kopyadan oluşur (21–25). Son yıllarda yapılan çalışmalar
Y kromomozumun intrakromozomal rekombinasyonlarından kaynaklanan ve gr/gr, b1/b3, b2/b3 olarak adlandırılan AZFc subdelesyonlarının bulunduğunu göstermiştir (25–27) (Şekil 2). İnfertil erkeklerde en sık olarak gr/gr
delesyonları %2.1–%12.5 oranında görülmektedir. Gr/gr
delesyonlarında DAZ (DAZ1/DAZ2) geninin dört kopyasından ikisinin ve BPY2 geninin üç kopyasından birinin kaybı gözlenir ve bu durum spermatojenik yetmezliğe neden
olur. B1/b3 ve b2/b3 delesyonlarında ise DAZ geninde iki
kopya BPY2 geninden bir ya da iki kopya bulunur (22–25).
AZFd bölgesi son yıllarda ayrı bir gen bölgesi olarak
AZFb ve AZFc bölgeleri arasında yer almaktadır. AZFd delesyonlu hastalar hafif oligospermisi veya normal spermsayısı olmasına rağmen anormal sperm morfolojisine sahip olabilirler (28).
Y kromozomu mikrodelesyonlarında genetik danışma
Erkek infertilitesine neden olanY kromozomundaki
mikrodelesyonların tespiti polimeraz zincir reaksiyonu
(PCR) yöntemi ile kolaylıkla yapılabilmesine rağmen bu
mikrodelesyonları düzeltmeye yönelik bir tedavi henüz
bulunmamaktadır. Y kromozom mikrodelesyonlarının tespiti hastaların oligozospermi nedeninin anlaşılmasına ve
prognozun belirlenmesine imkan vermektedir. Özellikle
AZFa ve AZF b mikrodelesyonlu hastalarda ICSI için TESE
ile sperm eldesinin mümkün olmadığının bilinmesi açısından oldukça önemlidir. Ayrıca Y kromozom mikrodelesyonu olan hastaların eşlerinde tekrarlayan düşük sayısının
arttığı ve çocuklarında öğrenme bozukluğu görülebileceği
belirtilmektedir (29). Bütün bu nedenlerden dolayı özellikle şiddetli oligospermi veya azospermisi olan hastalarda
ICSI öncesi mutlaka Y kromozom mikrodelesyon analizi
yapılmalıdır. Ailelere sahip olacakları erkek çocukların subfertil olabileceği ve bu çocukların cinsel olgunlaşma dönemlerinin takibi önerilmelidir. Sorularınız için bize ulaşın
Hazırlayanlar :
________________________________________________________
Uzm. Dr. Aysel Kalaycı Yiğin , Doç. Dr. Ahmet Gökçe İ. Ü. Cerrahpaşa Tıp Fakültesi, Tıbbi Genetik AD Sakarya Üniversitesi Tıp Fakültesi, Üroloji AD
KAYNAK:
Y kromozomu mikrodelesyonları ve erkek infertilitesi
________________________________________________________
1. Esteves SC1, Chan P. A systematic review of recent clinical practice
guidelines and best practice statements for the evaluation of the infertile male. Int Urol Nephrol 2015; 47: 1441–1456.
2. Kamali M, Baghestani AR, Kashfi F, Kashani H, Tava- johi S, Amirchagmaghi E. A survey on infertility in Royan Institute. Int J Fertil Steril
2007; 1: 23–26.
3. Gimenes F, Souza RP, Bento JC, Teixeira JJ, Maria-Engler SS, Bonini MG,
Consolaro ME. Male infertility: a public health issue caused by sexually
transmitted pathogens. Nat Rev Urol 2014; 11: 672–87.
4. Brugh VM, 3rd, Lipshultz LI. Male factor infertility: Evaluation and
management. Med Clin North Am 2004; 88: 367–385.
5. World Health Organization. WHO Manual for the Standardised Investigation and Diagnosis of the Infertile Male. Cambridge: Cambridge
University Press, 2000.
6. M. M. Matzuk, D.J. Lamb, The biology of infertility: research advances
and clinical challenges, Nat. Med 2008; 1197–1213.
7. A. Massart, W. Lissens, H. Tournaye, K. Stouffs, Genetic causes of spermatogenic failure, Asian J. Androl 2012; 14: 40–48.
8. Lahn BT and Page D. Functional coherence of the human Y chromosome. Science 1998; 278: 675–680.
9. Seda O, Liska F, Sedova L . Sex Determination. Multimedia E-textbook
of Medical Biology, Genetics and Genomics. Czech Republic: Institute
of Biology and Medical Genetics of the First Faculty of Medicine of
Charles University and the General Teaching Hospital; 2005.
10. Tiepolo L. and Zuffardi O. Localization of factors controlling spermatogenesis in the nonfluorescent portion of the human Y chromosome
long arm. Hum. Genet 1976; 34: 119–124.
11. M. Simoni, E. Bakker, C. Krausz. EAA/EMQN best practice guidelines for
molecular diagnosis of y chromosomal microdeletions. State of the art
2004. Int J Androl 2004; 27: 240–249.
12. Vogt, P. H., Edelmann, A., Kirsch, S., Henegariu, O., Hirschmann, P., Kiesewetter, F. et al. Human Y chromosome azoospermia factors (AZF)
mapped to different subregions in Yq11. Human Molecular Genetics
1996; 5: 933–943.13. Krausz, C., Quintana-Murci, L. & McElreavey, K. Prognostic value of Y
deletion analysis: what is the clinical prognostic value of Y chromosome microdeletion analysis? Human Reproduction 2000; 15: 1431–
1434.
14. Kamp, C., Huellen, K., Fernandes, S., Sousa, M., Schlegel, P. N., Mielnik,
A. et al. High deletion frequency of the complete AZFa sequence in men
with Sertoli-cell-only syndrome. Molecular Human Reproduction 2001;
7: 987–994.
15. Ma K, Inglis JD, Sharkey A, Bickmore WA, Hill RE, Prosser EJ, Speed RM,
Thomson EJ. A Y chromosome gene family with RNA-binding protein
homology: candidates for the azoospermia factor AZF controlling spermatogenesis. Cell 1993; 75: 1287–1295.
16. Prosser J, Inglis JD, Condie A, Ma K, Kerr S, Thakrar R, Taylor K, Cameron
JM, Cooke HJ. Degeneracy in human multi-copy RBM (YRRM), a candidate spermatogenesis gene. Mammal. Genome 1996; 7: 835–842.
17. Elliott DJ, Millar MR, Oghene K, Ross A, Kiesewetter F, Pryor J, McIntyre
M, Hargreave TB, Saunders PT, Vogt PH, Chandley AC and Cooke H.
Expression of RBM in the nuclei of human germ cells is dependent on a
critical region of the Y chromosome long arm. Proc Natl Acad Sci U S A
1997; 94: 3848–3853.
18. Elliott DJ. RBMY genes and AZFb deletions. J Endocrinol Invest 2000;
23: 652–658.
19. Krausz, C., Hoefsloot, L., Simoni, M. & Tuttelmann, F. EAA/EMQN best
practice guidelines for molecular diagnosis of Y-chromosomal microdeletions: state-of-the-art 2013. Andrology 2014; 2: 5–19.
20. Foresta, C., Moro, E. & Ferlin, A. Y chromosome microdeletions and alterations of spermatogenesis. Endocr. Rev 2001; 22: 226–239.
21. Vogt PH. AZF deletions and Y chromosomal haplogroups: history and
update based on sequence. Hum Reprod Update 2005; 11: 319–336.
22. Repping S, Skaletsky H, Brown L, van Daalen SK, Korver CM, Pyntikova
T, Kuroda-Kawaguchi T, de Vries JW, Oates RD, Silber S et al. Polymorphism for a 1.6-Mb deletion of the human Y chromosome persists
through balance between recurrent mutation and haploid selection.
Nat Genet 2003; 35: 247– 25123. Kuroda-Kawaguchi T, Skaletsky H, Brown LG et al: The AZFc region of
the Y chromosome features massive palindromes and uniform recurrent deletions in infertile men. Nat Genet 2001; 29: 279–286.
24. Repping S, van Daalen S, Brown L et al: High mutation rates have driven extensive structural polymorphism among human Y chromosomes.
Nat Genet 2006; 38: 463–467.
25. Lynch M, Cram DS, Reilly A, et al. The Y chromosome gr/gr subdeletion
is associated with male infertility. Mol Hum Reprod 2005; 11: 507–512.
26. Shahid M, Dhillon VS, Khalil HS, Sexana A, Husain SA. Associations
of Y-chromosome subdeletion gr/gr with the prevalence of Y-chromosome haplogroups in infertile patients. European Journal of HumanGenetics 2011; 19: 23/29.27. Lu C, Zhang J, Li Y et al: The b2/b3 subdeletion shows higher risk of
spermatogenic failure and higher frequency of complete AZFc deletion
than the gr/gr subdeletion in a Chinese population. Hum Mol Genet
2009; 18: 1122–1130.
28. Lahn BT, Pearson NM and Jegalian K. The human Y chromosome, in the
light of evolution. Nat Rev Genet 2001; 2: 207–216.
29. Aittomaki K, Wennerholm UB, Bergh C, et al. Safety issues inassisted
reproduction technology-Should ICSI patients have genetic testing before treatment? A practical proposition to help patient information.
Hum Reprod 2004; 19: 472–476.
Etiketler: akut prostatit, Altını Islatma Problemi, Ankara, ankarada tüp bebek fiyatları, Azoospermi, bebek istiyoruz, Belsoğukluğu, Böbrek Hastalıkları, Böbrek İltihabı, Cinsel Yolla Bulaşan Hastalıklar, Empotans, en iyi tüp bebek hastanesi, en iyi tüp bebek merkezi, en iyi üroloji doktorları, en iyi üroloji uzmanı, Ereksiyon Sorunu, Erektil Disfonksiyon, erkek üroloji doktoru, erkeklerde kısırlık tedavisinde kullanılan ilaçlar, Gevşek Penis, İdrar Kaçırma, İdrar Kesesi Hastalıkları, İdrar Kesesinde Daralma, İdrar Retansiyonu, İdrar Torbası İltihabı, İdrar Yapma Bozukluğu, İdrar Yollarında Yanma, İdrar Yolu Enfeksiyonu, İdrar Yolu Hastalıkları, İktidarsızlık, infertilite, İnmemiş Testis, işeme bozuklukları, Kan İşemek, kısırlık, Kriptorşidik Testis, MikroTESE, normal yolla bebek, Penis Eğriliği, Peyronie Hastalığı, prostad büyümesi, Prostat Büyümesi, Prostat Hastalıkları, Prostat İltihabı, Prostat Taşları, prostatit ameliyatı, Sertleşme Problemi, Sperm Sayısı Azlığı, Sünnet, Testis Ağrısı, Testis Kanseri, tüp bebek, tüp bebek cinsiyet belirleme fiyatı, tüp bebek tedavisi kaç para, türkiyenin en iyi üroloji doktoru, Üriner Enfeksiyon, ürolog doktor whatsapp iletişim, üroloji doktoru iletişim, üroloji uzmanı, Üroloji uzmanı Ankara, Ürolojik hastalıklar, Varikosel, varikosel tedavisi nasıl olur, yumurta donasyonu